RWE hat mit der Umsetzung der Medizinprodukteverordnung MDR 2017/745, die ab Mai 2021 vollständig umgesetzt wird, an Bedeutung gewonnen.
Die Hersteller von Medizinprodukten müssen ein System zur Generierung klinischer Nachweise entwickeln und umsetzen, das reale Daten zur Sicherheit und Leistung des Produkts generiert und gleichzeitig alle einschlägigen Rechtsvorschriften einhält.
Real World Evidence (RWE) ist die klinische Evidenz bezüglich der Verwendung und der potenziellen Vorteile oder Risiken eines Medizinprodukts, die aus der Analyse von RWD abgeleitet wird.
Beispiele für RWD:
Daten aus elektronischen Gesundheitsakten (EHRs)
Versicherungsansprüche und Abrechnungsdaten,
Daten aus Produkt- und Krankheitsregistern,
patientengenerierte Daten, auch im Rahmen der häuslichen Pflege
Daten aus anderen Quellen, die Aufschluss über den Gesundheitszustand geben können, z. B. aus mobilen Geräten.
“Herkömmliche klinische Daten” werden durch herkömmliche klinische Prüfungen (klinische Untersuchungen) gewonnen, die als Forschungsstudien definiert sind, bei denen ein oder mehrere Probanden prospektiv zugewiesen werden.
Am Ende einer klinischen Prüfung liegen in der Regel nur begrenzte Kenntnisse über die mittel- und langfristige Sicherheit und Leistung des Produkts vor. Schätzungen zu längerfristigen Daten können auf der Grundlage der Dauer von vor der Markteinführung durchgeführten Studien vorgenommen werden, doch sind diese im Allgemeinen nicht geeignet, um Extrapolationshypothesen im wirklichen Leben zu validieren, insbesondere Hypothesen zur Langlebigkeit von Implantaten (Hannan EL 2008).
Im Gegensatz zur RWE-Datenerhebung gibt es bei einer herkömmlichen klinischen Prüfung eher restriktive Zulassungskriterien, die sicherstellen sollen, dass die Teilnehmer an der betreffenden Krankheit leiden oder bestimmte Patientenmerkmale aufweisen.
Die Ziele der Erhebung von RWE-Daten im Rahmen der PMCF-Aktivitäten sind:
Studienpopulation, die die gesamte in der IFU angegebene Population repräsentiert.
Sie beinhaltet keine experimentelle Exposition.
Ziel ist es, die “gesamte Lebensdauer des Produkts” abzudecken.
Sie wird in allen Arten von klinischen Einrichtungen durchgeführt, nicht nur in spezialisierten Abteilungen.
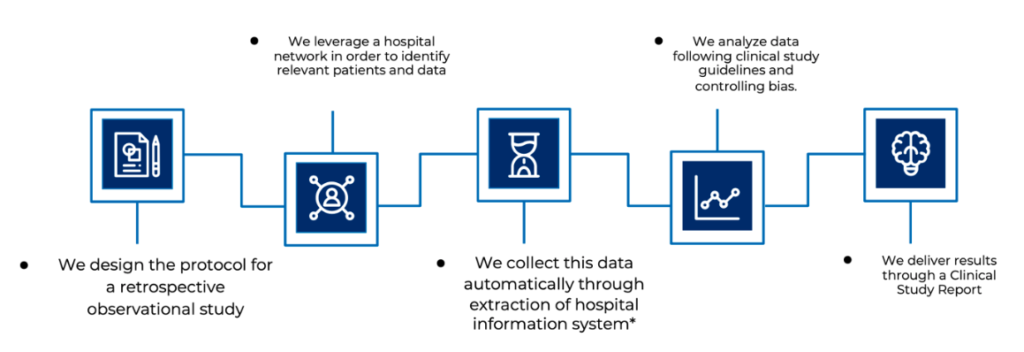
Jeder Schritt wird von unserem Expertenteam (Biostatistiker, Datenanalysten, klinische Forschungsassistenten, klinische Projektmanager) durchgeführt, das sich auf bewährte klinische Verfahren wie ISO14155:2020, fortschrittliche Analysetechniken und ein strenges Qualitätsmanagementsystem stützt.
Bei ECLEVAR MEDTECH wird vor der Durchführung einer klinischen RWE-Studie eine Machbarkeitsstudie durchgeführt, um die Qualität und Quantität der Daten sicherzustellen. Die Vorteile der Verwendung von RWD als gültige PMCF-Aktivität sind nicht von Bedeutung, wenn die Datenquelle von schlechter Qualität ist, da zuverlässige Entscheidungen nicht auf der Grundlage einer unzuverlässigen Datenquelle getroffen werden können.
Unter Datenqualität versteht man die Vollständigkeit, Konsistenz und Genauigkeit der Daten in dem an der Studie beteiligten Prüfzentrum.
Systeme zur Generierung von Real World Evidence, die Bestandteil der PMCF sind, müssen gemäß den in der MDR festgelegten Anforderungen an die technische Dokumentation dokumentiert werden. In den Anhängen II und III ist eine Reihe von Dokumenten aufgeführt, die für jedes Medizinprodukt erstellt werden müssen, darunter ein PMCF-Plan, ein PMCF-Bericht und ein Bericht über die klinische Bewertung (CER).
Darüber hinaus sind in Anhang XV der MDR eine Reihe von Anforderungen aufgeführt, die bei jeder Form von klinischer Studie eingehalten werden müssen, auch bei solchen, die RWE erzeugen sollen. Zu diesen Anforderungen gehören die Erstellung eines klinischen Prüfplans und eines Informationsschreibens an die Patienten, eines Fallberichtsformulars sowie eines statistischen Plans. Die Transparenz und Validität von Studien kann durch die Veröffentlichung von statistischen Analyseplänen (SAPs) erhöht werden, bevor auf die Daten zugegriffen wurde, um datengesteuerte Analysen von im Voraus geplanten Analysen zu unterscheiden.
| Projektphase | Liefergegenstände |
|---|---|
| 1 - STUDIENDESIGN | - Synopse der Studie - Klinischer Studienplan (CSP) |
| 2 - KRANKENHAUSVERWALTUNG | - Datenprüfung - Krankenhaus-Vereinbarung - Regulatorische Anforderungen und Dokumente |
| 3 - DATENERHEBUNG | - Dateien zur Datenerhebung - Berichte zur Datenprüfung - Endgültige Datenbank |
| 4 - ANALYSEN | - Statistischer Analyseplan (SAP) - Statistischer Bericht |
| 5 - ERGEBNISSE RÜCKERSTATTUNGEN | - Bericht über die klinische Studie (CSR) |
| 6 - PROJEKTLEITUNG | - Projektleitung |
Unsere Methodik entspricht den Standards der guten klinischen Praxis, die in ISO 14155:2020 und GCP sowie ISO 9001 festgelegt sind.
Weitere Informationen finden Sie in unserem Whitepaper mit dem BSI.
Das Medizinprodukt:
Gefäßprothesen aus gestrickten Polyestergeweben in gerader Schlauchform, die mit ultragereinigtem Kollagen bovinen Ursprungs imprägniert sind und zum Ersatz oder zur Überbrückung von Arterien, die durch ein Aneurysma oder eine arterielle Verschlusskrankheit geschädigt sind, angezeigt sind.
Problem:
Wie aus dem Bericht über die klinische Bewertung hervorgeht, werden die beabsichtigten Angaben zur klinischen Sicherheit und Leistung nicht ausreichend durch vorhandene klinische Nachweise gestützt. Um ein “Gefäßpflaster” auf dem europäischen Markt zu halten, muss der Sponsor eine PMCF-Studie durchführen, um ausreichende klinische Daten gemäß “Kapitel VI – Klinische Bewertung und klinische Prüfungen, insbesondere Abschnitte 62 – 82” zu gewinnen. Sowie der ISO 14155:2020.
Ziele
Bestätigung der Sicherheit und Leistung des vaskulären Geräts während seiner erwarteten Lebensdauer und an beiden anatomischen Stellen: Karotis und Oberschenkel.
Identifizierung und Analyse neu auftretender Risiken auf der Grundlage sachlicher Belege.
Sicherstellung, dass das in der EU-MDR genannte Nutzen-Risiko-Verhältnis weiterhin akzeptabel ist.
Identifizierung eines möglichen systematischen Missbrauchs oder einer nicht bestimmungsgemäßen Verwendung von Gerät X, um zu überprüfen, ob der beabsichtigte Zweck korrekt ist.
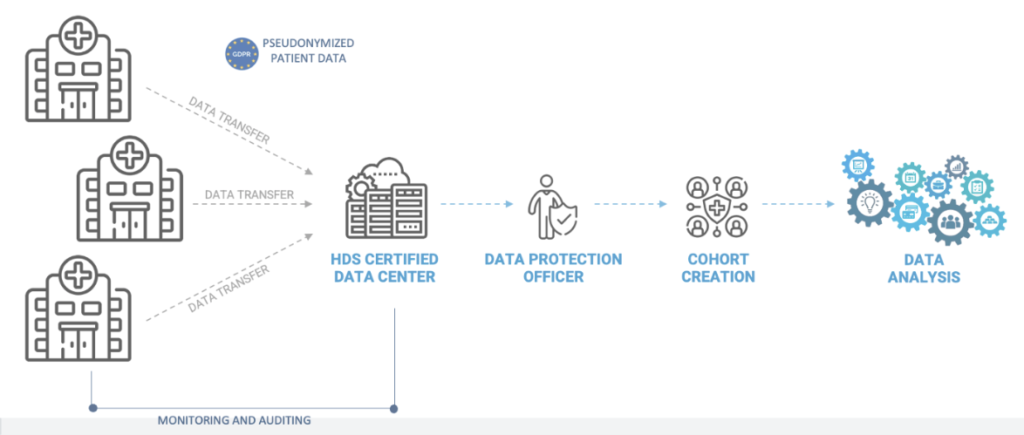
Methodik
Ein Sponsor führte eine multizentrische RWE-Studie durch, um klinische Daten für das Gefäßpflaster zu sammeln. Ziel war es, die kurz- und langfristigen Ergebnisse der Verwendung des Geräts in einer größeren und vielfältigeren Population zu untersuchen.
Alle Daten wurden aus den Krankenakten der einzelnen Patienten ab dem Zeitpunkt des Eingriffs (der als Ausgangswert der Studie gilt) bis maximal 3 Jahre nach dem Eingriff entnommen.
Mindestens 250 bis maximal 300 Probanden wurden an 3 bis 8 verschiedenen Standorten untersucht. Mindestens 100 Probanden wurden an der Halsschlagader und mindestens 100 an der Oberschenkelarterie untersucht.
Beteiligtes Krankenhausnetz:
CHU Valenciennes
CHU Nantes
CHU Brest
Unsere KOLs, die an der Studie beteiligt sind:
Prof.Yann Goueffic
Prof. Blandine Maurel-Desanlis
Dr. Bahaa NASR
Vorteile
Beitrag zu einer breiteren Evidenzbasis in der Entwicklung:
Repräsentative Bevölkerung
Akzeptiert von der benannten Stelle.
Anwendbare Verordnung und Leitlinie:
Artikel 61, Anhang I und Anhang XIV der Verordnung (EU) 2017/745 des Europäischen Parlaments und des Rates vom 5. April 2017 über Medizinprodukte (MDR),
ISO 14155:2020-07 (Abschnitt 6.3, Begründung für den Entwurf der klinischen Prüfung) Klinische Prüfung von Medizinprodukten am Menschen – Gute klinische Praxis.
Verordnung EU 722/2012: Verordnung (EU) über besondere Anforderungen hinsichtlich der in den Richtlinien 90/385/EWG und 93/42/EWG des Rates festgelegten Anforderungen an aktive implantierbare Medizinprodukte und unter Verwendung von Gewebe tierischen Ursprungs hergestellte Medizinprodukte.
NF EN ISO 7198: 2017- Kardiovaskuläre Implantate und extrakorporale Systeme. Vaskuläre Prothesen. Röhrenförmige Gefäßprothesen und Gefäßpflaster.

Je nachdem, in welchem Land Sie Ihre PMCF-Aktivität durchführen, ob Sie ein Register einrichten, eine Beobachtungsstudie oder einfach eine Umfrage durchführen, muss die Aktivität der ISO 14155 und der Datenschutzgrundverordnung entsprechen.
Die PMCF-Studie wird in Übereinstimmung mit der Datenschutz-Grundverordnung durchgeführt und folgt je nach Land einer bestimmten Methodik (Beispiele für Frankreich und Deutschland finden Sie unten).
Der Vorteil der Nutzung von RWE als gültige PMCF-Aktivität besteht darin, dass sie einen geringen regulatorischen Aufwand erfordert, da die zuständige Behörde und die Ethikkommission nicht zustimmen müssen, solange die Methodik der PMCF-Aktivität nicht von der klinischen Routinepraxis abweicht.

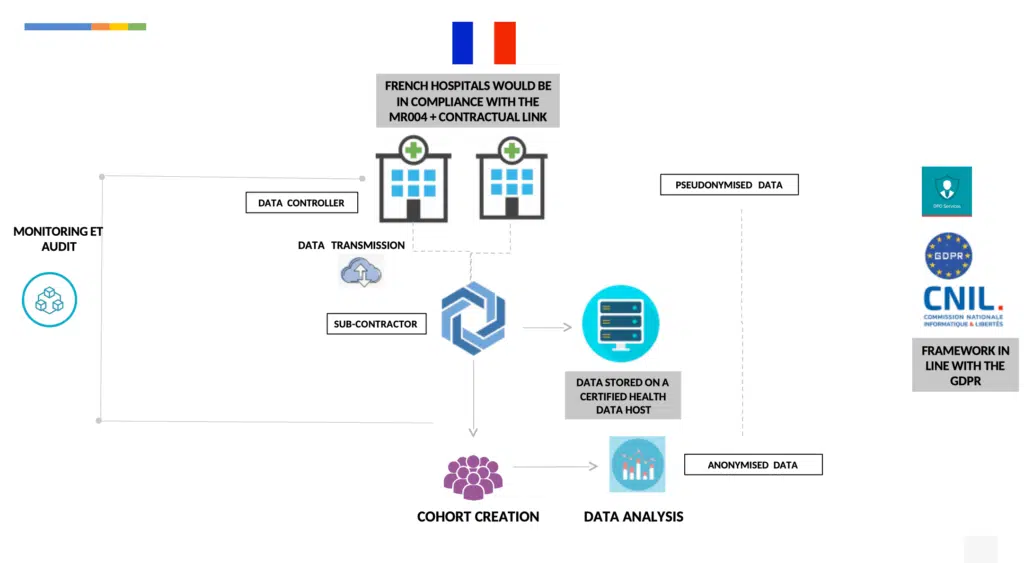
Durch die Verwendung einer Referenzmethodik namens “MR004” zur Durchführung von Studien, Forschungen und Evaluierungen zu retrospektiven und prospektiven Gesundheitsdaten, die nicht die menschliche Person einschließen.
Jedes Krankenhaus würde die MR004 als für die Datenverarbeitung Verantwortlicher befolgen, dies beinhaltet
Durchführung einer Folgenabschätzung für die verarbeiteten Daten im Voraus
Übermittlung pseudonymisierter Daten (im Sinne von Abschnitt 4 der GRPD)
eine Patienteninformation herausgeben: allgemein und individuell (dank einer Webseite)
Gewährleistung eines Auskunfts-, Berichtigungs- und Widerspruchsrechts gegen die Verarbeitung der Daten durch das Krankenhaus jedes Datenschutzbeauftragten
einen Vertrag mit dem Krankenhaus abschließen, der die Verpflichtungen im Zusammenhang mit der Verarbeitung personenbezogener Daten regelt
Keine Daten über religiöse Ansichten, Straftaten oder die NIS sammeln.
Andere Sicherheitsmaßnahmen, die vom Unterauftragnehmer durchgeführt werden:
Erhebung von Daten nach dem Grundsatz des eingebauten Datenschutzes und des Datenschutzes durch Voreinstellungen gemäß der Datenschutz-Grundverordnung
Speicherung der gesammelten Daten in einem zertifizierten Gesundheitsdaten-Hosting (gemäß Art. R1111-9 des französischen Gesetzes über das öffentliche Gesundheitswesen.

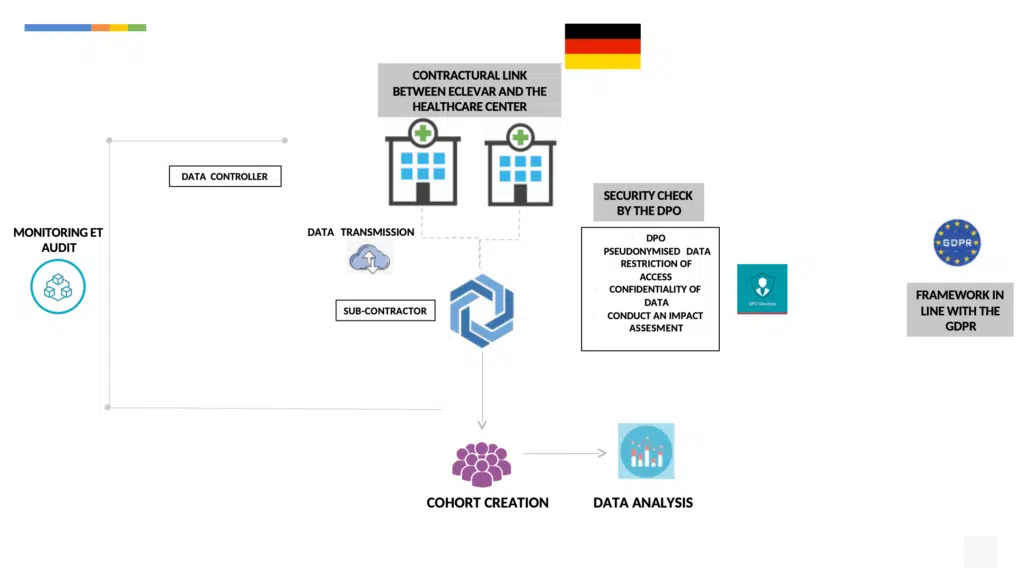
Abweichend von Artikel 9 der DSGVO ist die Verarbeitung von Gesundheitsdaten zulässig, wenn sie aus Gründen des öffentlichen Interesses im Bereich der öffentlichen Gesundheit erforderlich ist, um hohe Qualitätsstandards bei Medizinprodukten zu gewährleisten (Art. 22 DSGVO)
Verarbeitung: Zur Wahrung der Interessen der betroffenen Person und unter Berücksichtigung des Stands der Technik, des Umfangs, der Art und der Schwere der Risiken für die Rechte und Freiheiten natürlicher Personen sind geeignete und spezifische Maßnahmen zu treffen.
Maßnahmen zur Gewährleistung des Datenschutzes:
Ernennung eines Datenschutzbeauftragten (DSB)
Durchführung einer Folgenabschätzung
Erstellung einer Patienteninformation (Art. 13 und 14 GDPR)
Gewährleistung eines Auskunfts-, Berichtigungs- und Widerspruchsrechts gegen die Verarbeitung von Daten durch das Krankenhaus jedes Datenschutzbeauftragten
Pseudonymisierung von personenbezogenen Daten
Beschränkung des Zugangs zu personenbezogenen Daten innerhalb des für die Verarbeitung Verantwortlichen

Im Vereinigten Königreich ist das Information Commissioner’s Office (ICO) die unabhängige Behörde zur Wahrung der Informationsrechte im öffentlichen Interesse, zur Förderung der Offenheit von öffentlichen Einrichtungen und des Datenschutzes für Einzelpersonen.
Verarbeitung: Forschungseinrichtungen müssen alle einschlägigen rechtlichen Anforderungen erfüllen, und es muss eine Rechtsgrundlage gemäß der britischen Datenschutz-Grundverordnung angegeben werden. Da sensible personenbezogene Daten verarbeitet werden, wird wahrscheinlich eine Ausnahmeregelung nach Artikel 9 erforderlich sein.
Einschlägige rechtliche Rahmenbedingungen wie die Pflicht zur Vertraulichkeit nach Gewohnheitsrechtii durch Zustimmung müssen ebenfalls erfüllt werden. Allerdings wird die Auslegung der Einwilligung als Rechtsgrundlage für die Verarbeitung von Daten für die Forschung im Gesundheits- und Sozialwesen als nicht praktikabel angesehen.
Der Sponsor, der die im Rahmen des Prüfplans zu erfassenden Daten festlegt, fungiert in Bezug auf die Forschungsdaten als für die Verarbeitung Verantwortlicher. Handelt es sich bei den Daten um Routinedaten, die auch für andere Zwecke erhoben werden, wie z. B. Aufzeichnungen der Primärversorgung, dann gibt es gemeinsame für die Verarbeitung Verantwortliche für diese Daten. Gemeinsame für die Verarbeitung Verantwortliche machen die Erhebung und Verarbeitung von Daten komplexer und müssen berücksichtigt werden.
Ausnahmeregelungen für die Forschung
Artikel 14(5)(b) UK GDPR: Recht auf Information, wenn Daten aus anderen Quellen als der betroffenen Person erhoben werden.
Anhang 2 Absätze 27 und 28 der DSGVO 2018: Recht auf Auskunft
Schedule 2 Paragraphen 27 und 28 DPA 2018: Recht auf Berichtigung
Artikel 17 Absatz 3 Buchstabe d der britischen Datenschutz-Grundverordnung: Recht auf Löschung
Schedule 2 Paragraphen 27 und 28 der DPA 2018: Recht auf Einschränkung der Verarbeitung
Schedule 2 Paragraph 28 of DPA 2018: Recht auf Datenübertragbarkeit – nur für Archivierungszwecke im öffentlichen Interesse. Es gibt keine Ausnahme vom Recht auf Datenübertragbarkeit für wissenschaftliche oder historische Forschung oder Statistiken.
Artikel 21(6) der UK GDPR & Schedule 2 Paragraph 27 und 28 der DPA 2018: Recht auf Widerspruch – Art. 21 gilt nur für wissenschaftliche oder historische Forschung und statistische Zwecke. Schedule 2 Absatz 28 dient der Archivierung im öffentlichen Interesse
Ein Forscher kann diese Rechte im Rahmen der Ausnahmen einschränken, wenn die Erfüllung dieser Verpflichtungen das Forschungsprotokoll und die geplanten Ziele verhindern oder erheblich behindern würde. Es müssen eindeutige Sicherheitsvorkehrungen getroffen werden, um das Risiko des Entzugs dieser Rechte zu minimieren. Die Entscheidung über den Entzug dieser Rechte sollte auf der Grundlage von Fakten und dem Kontext des Rechts innerhalb der Forschung zu diesem Zeitpunkt getroffen werden. So hätte beispielsweise das Entfernen eines Teilnehmers in der Anfangsphase eines Projekts wahrscheinlich keine Auswirkungen, so dass das Recht auf Löschung gewährt werden kann, während das Entfernen von 30 % der Teilnehmer in einer fortgeschritteneren Phase erhebliche Auswirkungen auf die Forschung und ihre Ergebnisse haben könnte, so dass es eher gerechtfertigt wäre, diese Ausnahmeregelung in Anspruch zu nehmen.
Aufgrund der Auswirkungen des Austritts aus der EU muss der britische Rechtsrahmen etwas genauer betrachtet werden.
Für Nordirland gilt die EU-MDR, und daher sollten die neuen Anforderungen an die PMCF befolgt werden.
Für Großbritannien – England, Schottland und Wales – bleiben die Anforderungen an PMCF/PMS im Einklang mit den bereits erwähnten Richtlinien und einschlägigen MEDDEVs.
Wie in allen Ländern ist der Datenschutz bei der Verwendung von RWD von zentraler Bedeutung. Im Mai 2018 hat die Regierung des Vereinigten Königreichs das Datenschutzgesetz 2018 (Data Protection Act 2018, DPA 2018) in Kraft gesetzt, mit dem alle Klauseln der DSGVO umgesetzt wurden. Nach dem Austritt des Vereinigten Königreichs aus der EU schützte die EU-DSGVO die britischen Bürger nicht mehr. Um den Verlust des Datenschutzes zu verhindern, veröffentlichte die britische Regierung eine Aktualisierung des DPA 2018 mit der Bezeichnung “Data Protection, Privacy and Electronic Communication (amendments etc) (EU exit) regulations 2019”. Die DSGVO wird im nationalen Recht als UK GDPR beibehalten und steht neben dem geänderten DPA 2018.
Die wichtigsten Grundsätze, Rechte und Pflichten bleiben die gleichen. Die Einführung der DSGVO zielt darauf ab, die unterschiedlichen nationalen Umsetzungen des Datenschutzes zu harmonisieren, auch wenn nun das Risiko abweichender Auslegungen in der Rechtsprechung besteht.
Abonnieren Sie unseren Newsletter
30 Minuten kostenlose Beratung
Während 30 Minuten beantworten unsere Eclevar-Experten Ihre Fragen und führen Sie durch die nächsten Schritte!
BESUCHE UNS
ECLEVAR GMBH
ERFURT, Erfurt Hauptbahnhof
4th, 5th floor
Bahnhofstr. 38 Erfurt
99084
BLEIBEN SIE AUF DEM LAUFENDEN