2021年5月から完全施行される欧州医療機器規則 MDR2017/745の施行に伴い、RWEの重要性が増しています。
医療機器メーカーは、すべての関連法規を遵守しながら、機器の安全性と性能に関するリアルワールドデータを生成できるClinical Evidence Generation(臨床エビデンス生成)システムを開発・導入することが求められています。
リアルワールドエビデンス(RWE)とは、RWDの解析から得られた医療製品の使用方法、潜在的なベネフィットやリスクに関する臨床的なエビデンスのことです。
RWDの例:
電子医療記録(EHR)から得られるデータ
保険請求や診療報酬請求データ
製品および疾患レジストリからのデータ
在宅医療を含む、患者が作成したデータ
モバイル機器など、健康状態を知らせるその他の情報源から収集されたデータ
「従来の臨床データ」は、一人または複数の被験者を割り付けて実施するプロスペクティブ(前向き)研究として定義される従来の臨床試験(臨床調査)を通じて生成されるデータです。
臨床試験の終了時には、通常、製品の中長期的な安全性と性能に関する知見は限られたものとなります。より長期のデータについては、市販前の試験期間に基づいて推計しますが、こうした推定推計データは外挿仮説を実生活においても妥当とするには一般的に不十分です。インプラントのような長期に渡って使用する製品は特にそうです。(Hannan EL 2009)
VRWEデータ収集活動とは対照的に、従来の臨床試験では、臨床試験参加者が対象疾患または特定の患者特性を有しているように厳格な適格基準を設けることがほとんです。
PMCF活動の一環としてRWEデータを収集する目的:
IFU(取扱説明書)に示されている患者集団全体を代表する患者集団の調査
試験的な曝露を伴わないこと
製品のライフタイム全体を網羅する
特定の施設だけでなく、あらゆるタイプの臨床施設にて実施する
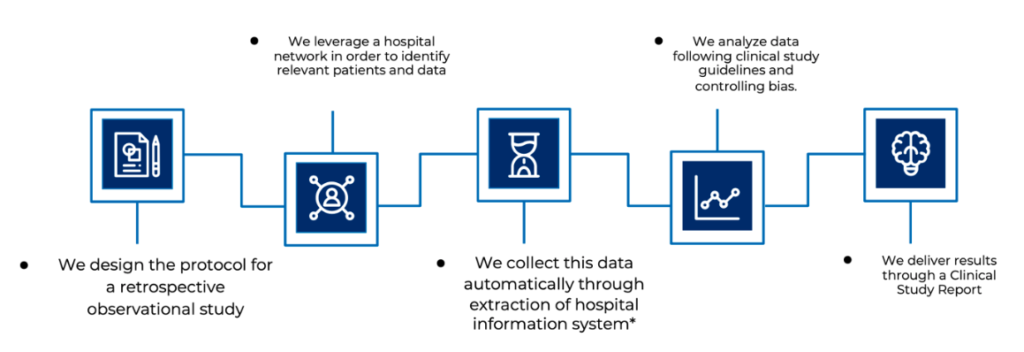
各ステップともに、当社の専門家チーム(生物統計学者、データ解析者、クリニカル・リサーチ・アシスタント、クリニカル・プロジェクトマネジャー)が、ISO14155:2020および高度な解析技術や信頼できる品質管理システムなどのベスト・クリニカル・プラクティスに則り、業務を行います。
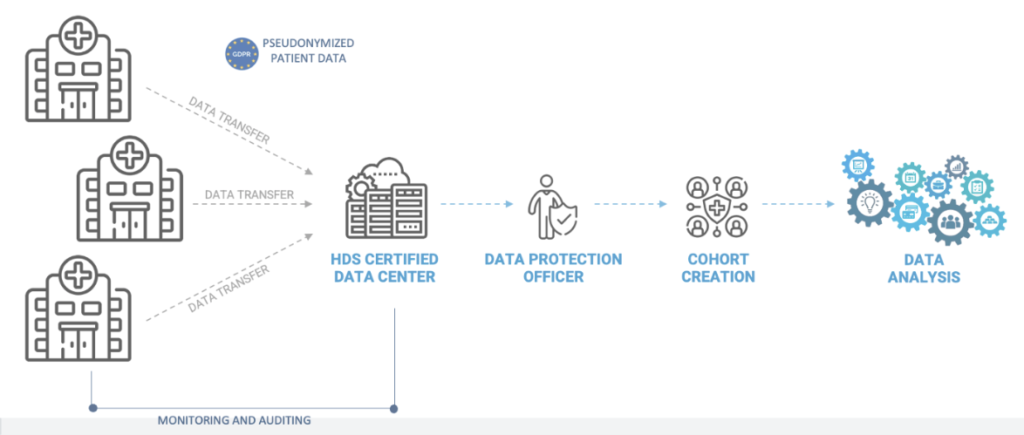
ECLEVAR MEDTECHでは、RWEの臨床試験に取り組む前に、データの質と量を確認するためのフィージビリティスタディを実施しています。データソースには使用目的に合った十分な質と量のデータがあることを確認することが重要です。RWDを有効なPMCF活動として使用する利点は、データソースが低品質である場合には、信頼できるデータに基づいた判断ができないため、意味がなくなってしまうからです。 データの質とは、研究に参画する調査施設全体における、データの完全性、一貫性、および正確性のことを指します。
PMCFの構成要素として、リアルワールドエビデンス生成システムについて、MDRで規定されている技術文書の要求事項に則り、文書化する必要があります。Annex IIおよびIIIに、PMCF計画、PMCF報告書および臨床評価報告書(CER)を含め、医療機器の有用性をサポートするうえで作成しなければならない文書が規定されています。
さらに、MDR Annex XVには、RWEを生成するための臨床研究を含め、あらゆる形式の臨床研究において遵守しなければならない要求項目が記載されています。こうした要求項目の中には、臨床調査計画、患者への通知状、ケースレポートフォーム、および統計解析計画を作成する必要があることも含まれています。データにアクセスして事前に計画した解析とデータに基づいた解析の識別を行う前に、統計解析計画書(SAP)を公表すると透明性と妥当性が高まるでしょう。
| プロジェクトフェーズ | 成果物 |
|---|---|
| 1 - スタディデザイン | - 試験の概要 - 臨床試験計画書(CSP) |
| 2 - 病院経営 | - データチェック - 病院との契約 - 規制要件と書類 |
| 3 - データ収集 | - データ収集ファイル - データ監査報告書 - 最終データベース |
| 4 - アナライザー | - 統計解析計画書(SAP) - 統計報告書 |
| 5 - 結果の復元 | 5 - 結果の復元 |
| 6 - プロジェクトマネジメント | - プロジェクトマネジメント |
私どもの方法論は、ISO 14155:2020、GCP、およびISO9001に概説されているGood Clinical Practice (GCP)の基準に準拠しています。
詳しい情報は、当社とBSIの共著のホワイトペーパーをご覧ください。
対象医療機器:
ポリエステル製の繊維からなる直管状の人工血管であり、牛由来の超精製コラーゲンを含浸し、動脈瘤や動脈閉塞性疾患によって損傷した動脈の置換やバイパス術を行うための機器である。
問題点:
臨床評価報告書に示されているように、意図した臨床的安全性と性能は、既存の臨床エビデンスでは十分な裏付けとはなっていない。欧州市場でVascular patchを継続販売するには、スポンサーは欧州医療機器規則(MDR)の「第VI章 臨床評価及び臨床試験、特に62-82項」およびISO14155:2020に従ってPMCFスタディを実施し、十分な臨床データを生成する必要がある。
目的:
この血管用医療機器の安全性と性能を製品の耐用年数を通じて、また、頸動脈と大腿骨の両ホフの部位に関して確認する。
実際のエビデンスに基づいて、起こりうるリスクの特定と分析を行う。
EU MDRで言及されているリスク・ベネフィット比が継続して許容範囲であることを保証する。
医療機器Xの体系的な誤使用や適応外使用の可能性を特定し、意図した使用方法が正しいことを検証する。
方法論:
スポンサーは、Vascular patchの臨床データを収集するためにRWE多施設スタディを実施した。その目的は、より規模の大きい、多様な母集団に当該医療機器を使用した際の、短期および長期のアウトカムを調査することであった。
データはすべて患者の手術時(スタディのベースラインとする)から術後最大3年間のカルテデータから抽出した。
3〜8施設で、最低250名、最大300名の患者のデータの評価を行い、頸動脈と大腿骨部位に関して、それぞれ最低100名の患者のデータの評価を行なった。
参加した系列病院:
CHU Valenciennes
CHU Nantes
CHU Brest
スタディに参加した当社のKOL:
Prof.Yann Goueffic
Prof. Blandine Maurel-Desanlis
Dr. Bahaa NASR
ベネフィット:
規模のより大きなエビデンス構築に寄与
代表的な母集団
ノーティファイドボディ(認証機関)によって認められた
適用される規則とガイドライン:
2017年4月5日発布の欧州議会及び理事会による医療機器に関する欧州規則(Regulation (EU) 2017/745, Article 61, Annex I, Annex XIV (MDR)。
ISO 14155:2020-07 (Section 6.3, Justification for the design of the clinical investigation) Clinical investigation of medical devices for human subjects–Good Clinical Practice (GCP)。
EU規則722/2012:能動埋込型医療機器及び動物由来組織を利用して製造された医療機器に関して理事会指令90/385/EEC及び93/42/EECの中で規定されている要求項目に関する要求事項を規定したEU規則。
NF EN ISO 7198:2017:心血管インプラントおよび対外システム、人工血管、帯状血管グラフトおよび血管パッチ。

PMCF活動を行う国によりますが、レジストリを行うのか、観察研究を行うのか、あるいは単にアンケート調査を行うかに関わりなく、ISO 14155及びGDPR(欧州一般データ保護規則)に則って活動を実施しなければなりません。
PMCF研究はGDPRに準拠して実施する必要があります。また、国によって、具体的な方法論が規定されています(下記にフランスとドイツの例を記載)。
有効なPMCF活動としてRWEを使用するメリットは、薬事規制のハードルが低くなるという点です。PMCF活動の方法論が日常の臨床行為から逸脱しない限り、当局および倫理委員会の承認を得る必要がないからです。

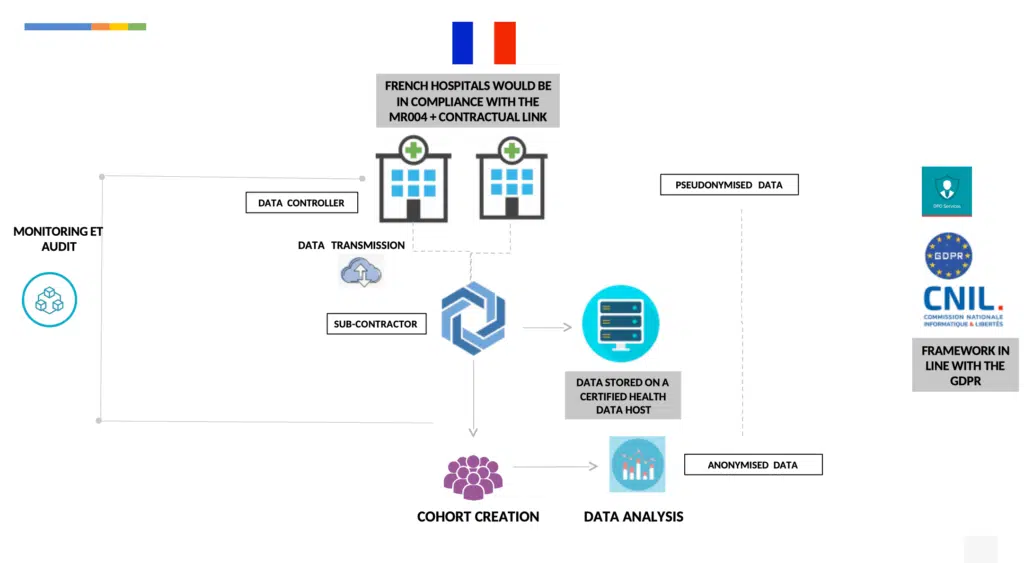
MR004と呼ばれる参照方法論を用いて、人の情報を含まないレトロスペクティブおよびプロスペクティブな医療データに関する調査や研究、評価を行うには、
各病院はデータ管理者としてMR004に従って行います。これには以下が含まれます:
事前に処理されたデータに関してインパクト評価を行う。
匿名化したデータ(GRPD第4項の定義内において)を送信する。
患者情報を発行する:一般および個人(ウェブページにより容易に可能)
各データ保護責任者の病院によるデータへのアクセス権、修正権およびデータ処理に対する拒否権を保証する。
個人データの処理に関する義務を規定する契約を病院と締結する。
宗教に関する意見や犯罪またはNIRに関するデータを収集してはなりません。
下請け業者が行うその他のセキュリティ対策:
GDPRが定めているデータ保護byデザイン・デフォルトの原則に従って、データを収集します。
収集したデータを認定された医療データ・ホストサーバーに保存します(フランス公衆衛生法のR1111-9条に基づいて)。

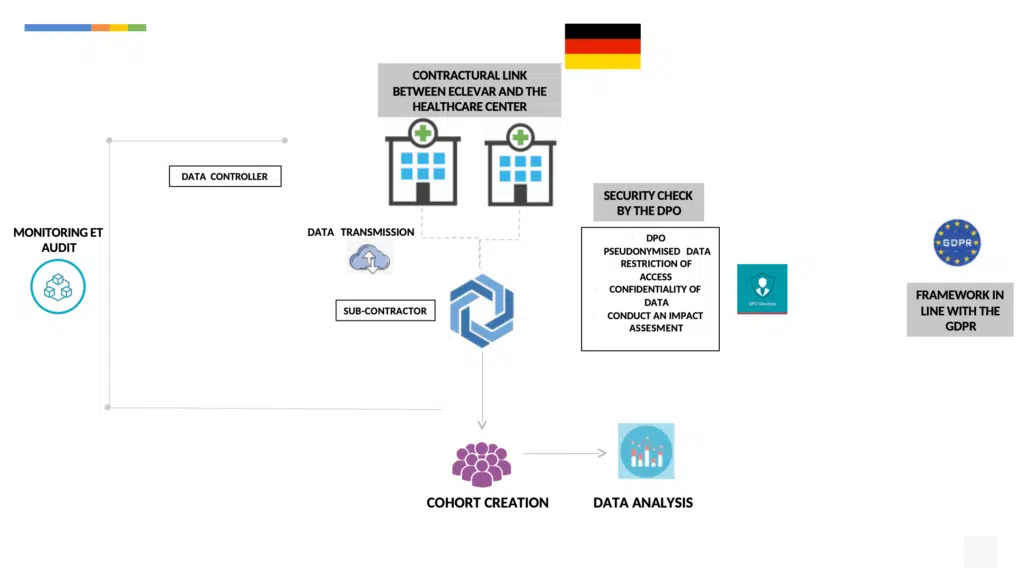
公衆衛生分野における公益上の理由から、医療機器の高い品質基準を確保する必要がある場合、GDPR第9条の適用除外という形で、医療データを取り扱うことが認められています(ドイツ・データ保護法第22条)。
データ処理:データ主体の利益を保護し、自然人の権利と自由に対するリスクの状態、規模、性質、重大性を考慮した適切かつ具体的な措置を講じなければなりません。
データ保護を確実に行うための対策:
データ保護責任者(DPO)の選任
インパクト評価の実施
患者情報の発行(GDPR13条、14条)
各データ保護責任者の病院によるデータへのアクセス権、修正権およびデータ処理に対する拒否権を保証する。
個人データの匿名化
コントローラー内の個人データへのアクセス制限

英国では、情報コミッショナーオフィス(ICO)が、独立機関として公共の利益のために情報の権利を守るために設立されており、公共機関による公開と個人に対するデータプライバシーを推進しています。
データ処理: 研究機関は、関連するすべての法的要求事項を満たし、英国のGDPRに基づく法的根拠を特定しなければなりません。内密性の高い個人データを処理するため、GDPR第9条の適用除外を受ける必要性が高いです。
同意によりコモンロー上の守秘義務などの関連する法的枠組みも満たす必要があります。しかし、医療データや社会福祉研究に関するデータ処理については、法的根拠としての同意の解釈は非現実的であると考えられています。
プロトコルに従って収集するデータを決定するスポンサーは、研究データに関する管理者としての責任を果たします。データが日常的なデータの場合、また、例えば、プライマリーケア記録など他の方法で収集されている場合は、そのデータの共同管理者が存在することになります。共同管理者が存在するとデータ収集と処理が複雑になるため、その点を考慮しなければなりません。
研究に関する適用除外
英国GDPR14条5項(b):本人以外からデータを収集した場合、通知を受ける権利。
DPA 2018, Schedule 2, Paragraph 27, 28:アクセス権
DPA 2018, Schedule 2, Paragraph 27, 28:修正する権利
英国GDPR第17条3項(d):消去する権利
DPA 2018, Schedule 2, Paragraph 27, 28:データ処理を制限する権利
DPA 2018, Schedule 2, Paragraph 28:データポータビリティの権利ー公益のためのアーカイブ目的に限定。科学的または歴史的な研究あるいは統計に関しては、データポータビリティの権利の免除はありません。
英国GDRP第21条6項及びDPA 2018, Schedule 2, Paragraph 27, 28:異議申し立ての権利ー第21条は科学的あるいは歴史的研究および統計目的のみ対象。Schedule 2, Paragraph 28は公益のためのアーカイブ目的に関するもの。
研究者は、これらの義務を果たすことが研究計画や計画された目的を妨げたり、著しく妨げたりすることを根拠に、例外規定内にあるようにこれらの権利を制限することができます。これらの権利を削除するリスクを最小化するために、明確なセーフガード(安全対策)を設けなければならない。これらの権利を削除する決定は、証拠に基づくものでなければならず、その時点の研究内におけるその権利の文脈を考慮したものでなければならない。例えば、プロジェクトの初期段階で1人の参加者を削除しても影響はないため、消去の権利が認められる可能性がありますが、より発展した段階で30%の参加者を削除すると、研究およびその結果に大きな影響を与える可能性があるため、この免除を利用する正当性がより高くなります。
EU離脱の影響により、英国の規制の枠組みについてはもう少し検討する必要があります。
北アイルランドについては、EUのMDRが適用されるため、PMCFに関する新しい要求事項に従う必要があります。
イギリス(イングランド、スコットランド、ウェールズ)については、PMCF/PMSの要求項目は、先に述べた指令と関連するMEDDEVsに沿ったものとなっています。
すべての国に関して、RWDを使用する際にはデータ保護が鍵となります。2018年5月、英国政府はデータ保護法2018(DPA2018)を施行しました。この法律は、GDPRのすべての条項を適用しています。英国のEU離脱に伴い、EU-GDPRは英国国民を保護しなくなりました。データ保護の喪失を防ぐため、英国政府は「Data Protection, Privacy and Electronic Communication (amendments etc) (EU exit) regulations 2019」というDPA 2018の更新を発表しました。GDPRはUK GDPRとして国内法で保持され、改正されたDPA 2018と並存しています。
主要な原則、権利、義務に変わりはありません。GDPRの導入は、データ保護に関する各国の異なる実施を調和させることを目的としていますが、現在、判例法における解釈が分かれるリスクは存在します。
ニュースレターを購読する
オフィス所在地
Tour Europlaza
20 avenue André Prothin
92 827 Paris La Défense Cedex
France
3rd Floor 207 Regent Street, London, W1B 3HH
オフィス所在地
ERFURT, Erfurt Hauptbahnhof
4th, 5th floor
Bahnhofstr. 38 Erfurt
99084
ECLEVAR Australia
Umina Beach NSW 2257, Australia