Dazu gehört die Bestätigung der Sicherheit und Leistung während der erwarteten Lebensdauer Ihres Medizinprodukts oder IVD:
Identifizierung bisher unbekannter Nebenwirkungen
Überwachung identifizierter Nebenwirkungen und Kontraindikationen
Identifizierung und Analyse neu auftretender Risiken
Sicherstellung der kontinuierlichen Akzeptanz des Nutzen-Risiko-Verhältnisses
Identifizierung eines möglichen systemischen Missbrauchs oder einer Verwendung außerhalb des zugelassenen Bereichs.
Die durch die ausgewählten PMCF Aktivitäten gewonnenen Daten fließen in Ihre Post Market Surveillance (PMS) und Ihren Bericht über die klinische Bewertung (CER)/Leistungsbewertung (PER) ein.
Ihr Plan für die klinische Nachbeobachtung nach der Markteinführung sollte sowohl allgemeine als auch spezifische Aktivitäten mit einem klaren Ziel für diese Aktivitäten enthalten. Welche Daten wollen Sie generieren? Sind die Methoden angemessen?
Um diese Fragen zu beantworten, müssen Sie die verschiedenen Optionen der PMCF Aktivitäten in Betracht ziehen.
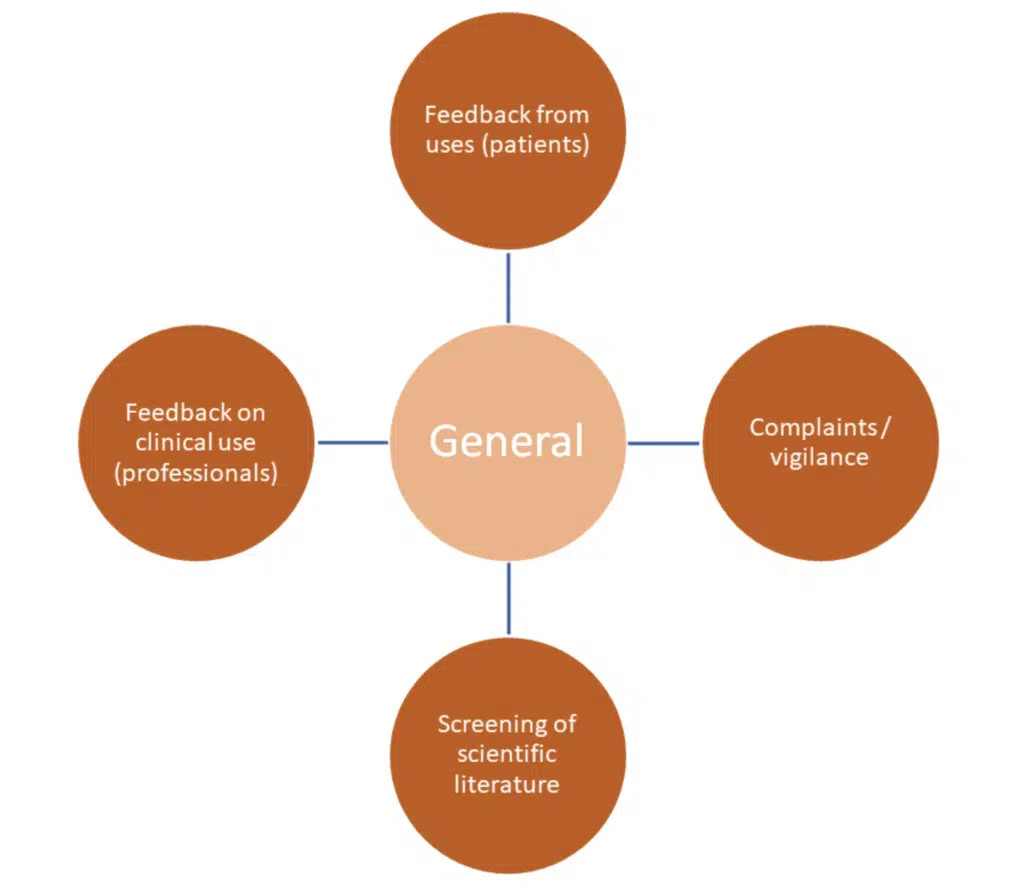
Allgemeine Aktivitäten dienen der Informationssammlung – oft sind es allgemeine, subjektive Daten, die dem Hersteller für sich genommen keine soliden wissenschaftlichen Beweise für Sicherheit und Leistung liefern. Sie sollten in Verbindung mit spezifischen Aktivitäten verwendet werden.
Diese Methoden unterliegen oft Verzerrungen und Schwankungen zwischen den Quellen.
Einige der wichtigsten Herausforderungen:
Literaturrecherche – begrenzte Daten über das zu prüfende Produkt, schlechte Qualität der Literatur. Es sind auch Überlegungen zur Verwendung gleichwertiger Produkte und der zu diesen Produkten veröffentlichten Literatur anzustellen. Wenn Äquivalenz verwendet werden soll, muss die Gleichwertigkeit eindeutig nachgewiesen werden – bitte prüfen Sie die MDCG 2020-5 und wenden Sie sich im Zweifelsfall an uns.
Zugang zu Patienten und Anwendern: Haben Sie angemessenen Zugang, Einwilligung und Datenschutz?
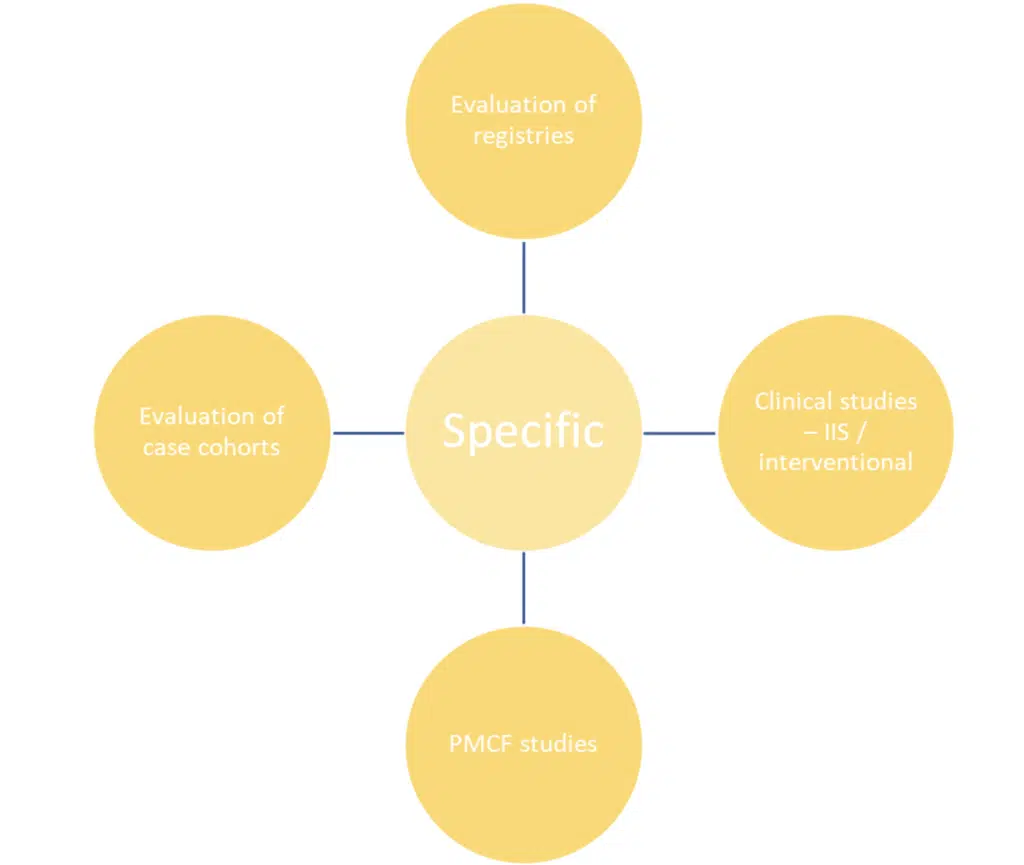
Spezifische Methoden sind genau das – spezifischer und stärker auf die Gewinnung eines wissenschaftlich aussagekräftigen Datensatzes zugeschnitten. Sie haben einen definierten Zweck, eine definierte Population und einen definierten Datensatz – wenn sie gut durchgeführt werden, werden diese Aktivitäten Ihnen die Rohdaten zu Ihrem Produkt liefern, um den Nachweis der Sicherheit und Leistung zu unterstützen.
Welche Aktivitäten auch immer gewählt werden, der PMCF-Plan muss eine klare Begründung für die Wahl enthalten.
Randomisierte Kontrollstudien
Prospektive kontrollierte Studie/Erweiterung der klinischen Prüfung vor dem Inverkehrbringen
Retrospektive Studie
Systematische Überprüfung – Meta-Analyse
Beobachtungsstudien
Registerstudien
Hinweis: Sie gelten als obligatorisch für Produkte, die:
die ihre CE-Kennzeichnung aufgrund der Gleichwertigkeit erhalten haben
eine neuartige Technologie sind
Längerfristige Sicherheit und Leistung sind nicht bekannt
in einer Hochrisikopopulation verwendet werden
Diese Studien sollten über definierte Protokolle verfügen, in denen mindestens Folgendes festgelegt ist: definierte Population und Stichprobengröße, Ein- und Ausschlusskriterien, geeignete Ziele und Endpunkte sowie Nachuntersuchungen.
Möglicherweise müssen ethische und behördliche Genehmigungen eingeholt werden.
Eine PMCF-Studie sollte, wie eine präklinische Studie, den Erwartungen der ISO 14155:2020 entsprechen.
Herausforderungen:
Unangemessenes oder ungerechtfertigtes Design.
Zusätzliche Kosten
Längere Fristen für die Datengenerierung
Erlangung von Genehmigungen
Register: Dabei kann es sich um ein produktspezifisches Register oder ein größeres produktartiges Register handeln – wiederum entweder für eine kleinere Population oder ein Gebiet oder sogar landesweit, wie das National Joint Registry.
Ein gut konzipiertes und gut genutztes Register kann eine großartige Quelle für Rohdaten für Ihr Produkt sein. Eine umfassende Analyse hat den Vorteil, dass sie wissenschaftlich fundierte Daten über Sicherheit und Leistung liefert.
Herausforderungen:
Einrichtung und Betrieb können kostspielig sein.
Begrenzte Reichweite – die Beteiligung von Patienten und Angehörigen der Gesundheitsberufe kann eine Herausforderung sein, da es oft nicht möglich ist, einen Auftrag zu erteilen.
Größere nationale/globale Register enthalten möglicherweise nur begrenzte relevante Daten für den Zweck der PMCF. Der Nutzen der Daten sollte immer berücksichtigt werden.
Erhebungen bieten ein gewisses Maß an Flexibilität, sie können allgemein, aber auch sehr spezifisch gestaltet sein – sie können eine breite Palette von Anforderungen an die Datenerhebung erfüllen.
Allgemeine Erhebungen sind in der Regel retrospektiv angelegt, d. h. der Endnutzer wird gebeten, sich an Informationen über das Gerät und seine Verwendung zu erinnern.
Spezifische Erhebungen können auf Patientenebene und fallspezifisch sein – dies kann eine einzelne Erhebung oder eine Reihe von Erhebungen sein, die die Nutzung der Geräte verfolgen (prospektiv). Die Befragung kann direkt beim Patienten oder über einen Angehörigen der Gesundheitsberufe anhand von Patientenakten erfolgen. Die aus dieser Art von Aktivitäten gewonnenen Daten sind von höherer Qualität – sie liefern in der Regel klinische Daten zu den untersuchten Produkten in Form von Daten zu Patientenergebnissen und klinischen Indikationen.
Außerdem gelten sie als relativ einfach zu konzipieren und durchzuführen.
Sie sollten jedoch angemessen eingesetzt werden, und wie bei allen Aktivitäten muss ihr Einsatz im Rahmen des PMCF-Plans begründet werden.
Herausforderungen:
Zugang zu den Endnutzern – dieser kann begrenzt/eingeschränkt sein, z. B. wenn ein Händler eingeschaltet wird.
Verzerrungen – die Struktur der Umfrage ist wichtig, um Verzerrungen zu minimieren. Ein größeres Problem sind die subjektiven Antworten der Angehörigen der Gesundheitsberufe.
Mangel an Antworten – die Umfrage muss zugänglich und einfach auszufüllen sein. Wenn sie zu lang, zu kompliziert oder nicht relevant sind, können die Nutzer beim Ausfüllen “ermüden”.
Verlust des Fokus – wie bereits erwähnt, muss die Umfrage eine klare Richtung haben – wenn zu viele Ziele verfolgt werden, kann die Umfrage nicht klar genug sein und die zurückgesandten Daten können verzerrt sein.
Die Einhaltung der GDPR ist entscheidend
Eine ethische Prüfung und Genehmigung kann erforderlich sein – die einzelnen Länder können unterschiedliche Anforderungen haben.
Von Forschern initiierte Studien: Sie werden oft als ein weiteres nützliches Instrument angesehen, da ein Großteil der Planung und Durchführung der Studie von einer dritten Partei übernommen wird. Wenn sie gut konzipiert sind, sind sie natürlich nützlich für die Gewinnung von Sicherheits- und Leistungsdaten, allerdings liegt die Verantwortung an anderer Stelle, was zu Problemen führen kann.
Herausforderungen:
Begrenzte Kontrolle über Verhalten oder Datensätze
Potenziell können zusätzliche Kosten anfallen, wenn Sie eine aktive Rolle übernehmen wollen und können.
Es besteht weniger Gewissheit, dass Sie die wahren Daten erhalten – das wahre Bild von Sicherheit und Leistung.
Anhang XIV Teil B
6.2. Der PMCF-Plan muss mindestens Folgendes enthalten:
die anzuwendenden allgemeinen Methoden und Verfahren der PMCF, wie z. B. das Sammeln von klinischen Erfahrungen, Rückmeldungen von Anwendern, das Screening der wissenschaftlichen Literatur und anderer Quellen für klinische Daten
die spezifischen Methoden und Verfahren der PMCF, die angewandt werden sollen, wie die Auswertung geeigneter Register oder PMCF-Studien;
eine Begründung für die Angemessenheit der unter den Buchstaben a) und b) genannten Methoden und Verfahren;
einen Verweis auf die einschlägigen Teile des Berichts über die klinische Bewertung gemäß Abschnitt 4 und auf das Risikomanagement gemäß Anhang I Abschnitt 3;
die spezifischen Ziele, die von der PMCF behandelt werden sollen;
eine Bewertung der klinischen Daten über gleichwertige oder ähnliche Produkte;
Verweis auf alle einschlägigen CS, harmonisierte Normen, sofern vom Hersteller verwendet, und einschlägige Leitlinien zur PMCF; und
einen detaillierten und hinreichend begründeten Zeitplan für die vom Hersteller durchzuführenden PMCF Aktivitäten (z. B. Analyse der PMCF-Daten und Berichterstattung).
Dies ist das erforderliche MINDESTMASS. PMCF-Pläne sollten so konzipiert sein, dass sie reale Nachweise über die Sicherheit und Leistung Ihres Produkts bei normaler Verwendung liefern. Dabei handelt es sich um eine Längsschnittdatenerfassung, die Nachweise für die Sicherheit und Leistung während der gesamten Lebensdauer des Produkts liefert.
Der Plan muss detailliert sein und eine klare Begründung für die gewählten Aktivitäten enthalten – wie werden die Daten gewonnen, die Sie auswerten wollen. Was ist für Ihr Produkt relevant?
Verwenden Sie die in der MDCG 2020-7 enthaltene Vorlage für den PMCF-Plan!
Die MDCG 2020-8 enthält Leitlinien und eine Vorlage für den Bericht.
Ein PMCF-Bericht sollte:
mit dem PMCF Plan übereinstimmen
darlegen, welche Aktivitäten durchgeführt wurden
die aus den PMCF Aktivitäten gewonnenen Daten analysieren
die Ergebnisse dokumentieren
Teil der technischen Dokumentation sein
muss jährlich aktualisiert werden Klasse III und implantierbare Produkte.
Es ist wichtig, daran zu denken, dass dieser Bericht bei der Aktualisierung der CER für Ihr Produkt in Betracht gezogen wird. Bei der Überprüfung der Schlussfolgerungen des PMCF-Zyklus gibt es eine Reihe von Überlegungen.
Sind Aktualisierungen der IFUs erforderlich?
Muss die Risikomanagementakte überprüft werden?
Ist die Kennzeichnung noch korrekt?
Sollten die Anwendungsgebiete geändert werden?
Sind die Kontraindikationen noch korrekt?
Sind formelle Abhilfemaßnahmen erforderlich?
Sind Änderungen an der Konstruktion oder Herstellung erforderlich?
Es handelt sich um ein technisches Dokument, das klar dargestellt werden und eine wissenschaftlich fundierte Schlussfolgerung enthalten sollte, wobei der Schwerpunkt auf der Sicherheit und Leistung des Produkts liegt. Es handelt sich um ein lebendiges Dokument, das aktualisiert und sorgfältig geprüft werden muss.
Wenn es Lücken gibt – das kommt häufig vor. Wenn Sie “Datenlücken” oder fehlende Nachweise in einem bestimmten Bereich entdecken, müssen diese überprüft und bewertet werden. Dies sollte nachgewiesen werden und Teil der Schlussfolgerungen sein. Wenn es sich um eine erhebliche Lücke handelt, müssen möglicherweise weitere Aktivitäten in Betracht gezogen und mit der benannten Stelle vereinbart werden (falls zutreffend). Kleinere Lücken können gerechtfertigt sein, aber es sollten Abhilfemaßnahmen ergriffen werden, um sie in Zukunft zu schließen. Jeder Fall ist anders, und die Entscheidung muss klar begründet und dokumentiert werden.
Die neue Verordnung sieht eine deutlich verstärkte Prüfung durch die BS vor. Es gibt wichtige Zeitpunkte, zu denen die BS wahrscheinlich Ihren PMCF-Plan und Ihre Daten überprüfen wird:
Während der ersten Konformitätsbewertung
Wenn Sie eine Überprüfung wegen wesentlicher Änderungen einreichen
Bei der Rezertifizierung
Bei der Überprüfung eines SSCP oder Ihrer PSURs
Routineüberprüfung – z. B. jährlich für Produkte der Klasse III und implantierbare Produkte
Vergessen Sie nicht, dass die zuständigen Behörden die Daten auch anfordern können – sie müssen wie im PMS-Plan vorgesehen erstellt und verfügbar sein.
Dies ist keine erschöpfende Liste, sondern nur eine Auflistung der wichtigsten Überprüfungspunkte. Auch hier geht es darum, den “Lebenszyklus”-Ansatz und die konsequente Überprüfung über den gesamten Lebenszyklus hinweg zu demonstrieren.
Es ist nicht nur ein Kästchen, das man ankreuzen muss – es ist eine wichtige Funktion, die das Wissen über Ihr Produkt aufbaut und die Gewissheit gibt, dass Ihr Produkt weiterhin funktioniert und dass das Nutzen-Risiko-Verhältnis weiterhin akzeptabel ist und die Risiken so weit wie möglich gemindert werden.
Einschlägige Leitlinien:
MDCG 2020-7 Vorlage für einen PMCF-Plan: Ein Leitfaden für Hersteller und benannte Stellen
MDCG 2020-8 PMCF-Bewertungsbericht: Ein Leitfaden für Hersteller und benannte Stellen
MDCG 2021-6 Fragen und Antworten zu klinischen Prüfungen
MEDDEV 2.12/2 – Klinische Nachbeobachtungsstudien nach dem Inverkehrbringen
Abonnieren Sie unseren Newsletter
30 Minuten kostenlose Beratung
Während 30 Minuten beantworten unsere Eclevar-Experten Ihre Fragen und führen Sie durch die nächsten Schritte!
BESUCHE UNS
ECLEVAR GMBH
ERFURT, Erfurt Hauptbahnhof
4th, 5th floor
Bahnhofstr. 38 Erfurt
99084
BLEIBEN SIE AUF DEM LAUFENDEN