La GEF est devenue de plus en plus importante suite à la mise en œuvre du règlement sur les dispositifs médicaux MDR 2017/745, pleinement mis en œuvre à partir de mai 2021.
Les fabricants de dispositifs médicaux sont tenus de développer et de mettre en œuvre un système de génération de preuves cliniques qui génère des données du monde réel sur la sécurité et les performances des dispositifs tout en restant en conformité avec l’ensemble de la législation pertinente.
Les preuves du monde réel (RWE) sont les preuves cliniques concernant l’utilisation, et les avantages ou les risques potentiels, d’un produit médical dérivées de l’analyse des RWD.
Exemples de RWD :
Les “données cliniques traditionnelles” sont générées par un essai clinique traditionnel (investigation clinique) qui se définit comme une étude de recherche dans laquelle un ou plusieurs sujets humains sont affectés de manière prospective.
À la fin d’un essai clinique, on dispose généralement de connaissances limitées sur la sécurité et les performances à moyen et long terme du dispositif. Des estimations sur les données à plus long terme peuvent être faites sur la base des durées des essais avant commercialisation, mais elles sont généralement inadéquates pour valider les hypothèses d’extrapolation dans la vie réelle, en particulier les hypothèses de longévité des implants (Hannan EL 2008).
Contrairement à l’activité de collecte de données RWE, un essai clinique traditionnel est plus susceptible d’avoir des critères d’éligibilité restrictifs conçus pour garantir que les participants sont atteints de la maladie en question ou présentent des caractéristiques de patients spécifiques.
Les objectifs de la collecte de données d’EEF dans le cadre des activités du PMCF sont les suivants :
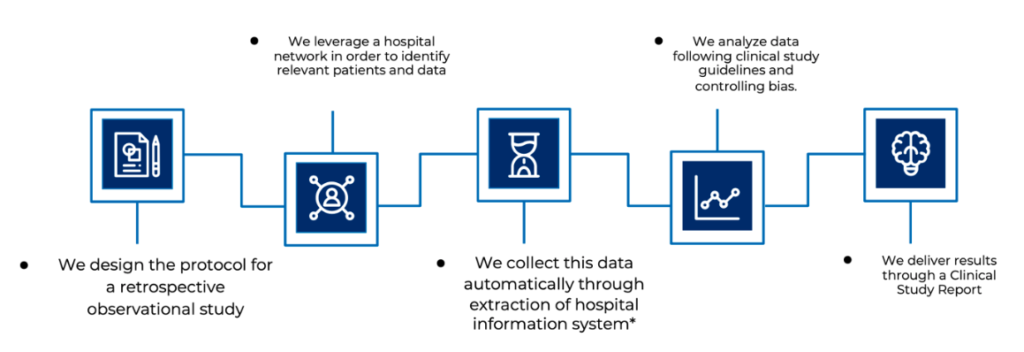
Chaque étape est prise en charge par notre équipe d’experts (biostatisticiens, analystes de données, assistants de recherche clinique, chefs de projet clinique) qui s’appuie sur les meilleures pratiques cliniques telles que la norme ISO14155:2020, des techniques d’analyse avancées et un solide système de gestion de la qualité.
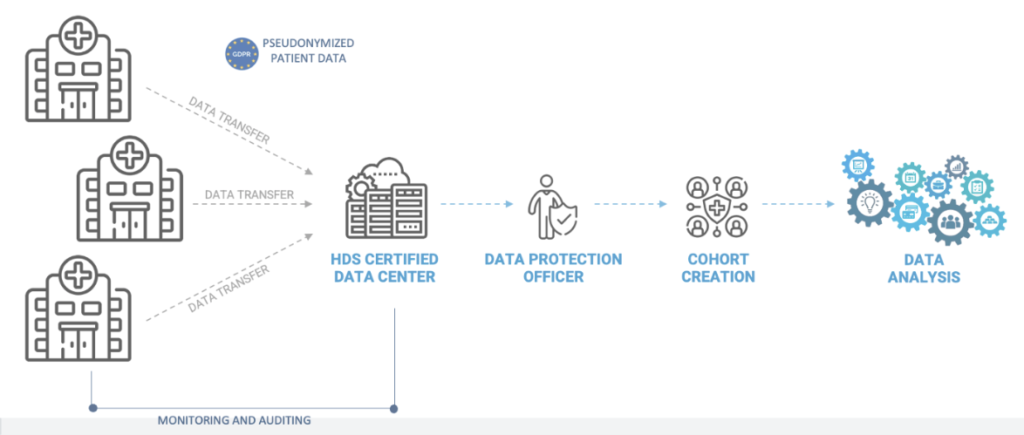
Avec ECLEVAR MEDTECH, avant de s’engager dans une étude clinique RWE, une étude de faisabilité est menée pour s’assurer de la qualité et de la quantité des données. Il est important de démontrer que la source de données est de qualité et de quantité suffisantes pour l’utilisation prévue. Les avantages de l’utilisation de l’EFR en tant qu’activité valide du CMFP ne sont d’aucune pertinence si la source de données est de mauvaise qualité, car des décisions fiables ne peuvent être prises sur la base d’une source de données non fiable.
La qualité des données est l’exhaustivité, la cohérence et l’exactitude des données dans l’ensemble du centre d’investigation participant à l’étude.
Les systèmes de génération de preuves du monde réel, en tant que composante du PMCF, devront être documentés conformément aux exigences en matière de documentation technique telles que spécifiées dans le RIM. Les annexes II et III spécifient une série de documents qui doivent être produits à l’appui de chaque dispositif médical, y compris un plan PMCF, un rapport PMCF et un rapport d’évaluation clinique (CER).
En outre, l’annexe XV du RIM énumère une série d’exigences qui doivent être respectées pour toute forme d’étude clinique, y compris celles destinées à générer des EFR. Ces exigences comprennent la nécessité de produire un plan d’investigation clinique et une lettre d’information aux patients, un formulaire de rapport de cas ainsi qu’un plan statistique. La transparence et la validité des études peuvent s’accroître avec la publication des plans d’analyse statistique (PAS) avant l’accès aux données, afin de discerner les analyses fondées sur les données des analyses planifiées à l’avance.
| Phase du projet | Produits livrables |
|---|---|
| 1 - CONCEPTION DE L'ÉTUDE | - Synopsis de l'étude - Plan d'étude clinique (PEC) |
| 2 - GESTION DES HÔPITAUX | - Vérification des données - Accord de l'hôpital - Exigences et documents réglementaires |
| 3 - COLLECTE DES DONNÉES | - Fichiers de collecte de données - Rapports d'audit des données - Base de données finale |
| 4 - ANALYSES | - Plan d'analyse statistique (PAS) - Rapport statistique |
| 5 - RESTITUTIONS DES RÉSULTATS | - Rapport d'étude clinique (CSR) |
| 6 - GESTION DE PROJET | - Gestion de projet |
Notre méthodologie est conforme aux normes de bonnes pratiques cliniques décrites dans les normes ISO 14155:2020 et BPC et ISO 9001.
Pour plus d’informations, lisez notre livre blanc avec le BSI.
Le dispositif médical :
prothèses vasculaires en tissu polyester tricoté, de forme tubulaire droite, imprégnées de collagène ultra-purifié d’origine bovine, et indiquées pour le remplacement ou le contournement d’artères endommagées par un anévrisme ou une maladie artérielle occlusive.
Problème :
Comme le montre le rapport d’évaluation clinique, les allégations prévues en matière de sécurité et de performance cliniques ne sont pas suffisamment étayées par les preuves cliniques existantes. Pour maintenir un “patch vasculaire” sur le marché européen, le promoteur doit mener une étude PMCF pour générer des données cliniques suffisantes conformément au “Chapitre VI – Évaluation clinique et investigations cliniques, spécifiquement les sections 62 – 82”. Ainsi que la norme ISO 14155:2020.
Objectifs
Confirmer la sécurité et les performances du dispositif vasculaire tout au long de sa durée de vie prévue et sur les deux sites anatomiques : Carotide et fémorale.
Identifier et analyser les risques émergents sur la base de preuves factuelles.
Assurer l’acceptabilité continue du rapport bénéfice-risque mentionné dans le MDR de l’UE.
Identifier une éventuelle mauvaise utilisation systématique ou une utilisation hors indication du dispositif X pour vérifier que l’objectif prévu est correct.
Méthodologie
Un sponsor a mené une étude multicentrique RWE pour recueillir des données cliniques sur le patch vasculaire. L’objectif était d’examiner les résultats à court et à long terme de l’utilisation du dispositif lorsqu’il est exposé à une population plus importante et plus variée.
Toutes les données ont été extraites des dossiers médicaux de chaque patient à partir du moment de l’intervention chirurgicale (considéré comme le point de départ de l’étude) jusqu’à un maximum de 3 ans après l’intervention.
Un minimum de 250 et un maximum de 300 sujets ont été évalués sur 3 à 8 sites différents. Au moins 100 sujets ont été évalués en localisation carotidienne et au moins 100 en localisation fémorale.
Réseau hospitalier concerné :
CHU Valenciennes
CHU Nantes
CHU Brest
Nos KOLs impliqués dans l’étude :
Pr Yann Goueffic
Pr Blandine Maurel-Desanlis
Dr. Bahaa NASR
Avantages
Contribuer à l’élaboration d’un plus grand ensemble de preuves :
Population représentative
Accepté par l’organisme notifié.
Règlement et ligne directrice applicables :
Article 61, annexe I et annexe XIV du règlement (UE) 2017/745 du Parlement européen et du Conseil du 5 avril 2017 relatif aux dispositifs médicaux (MDR),
ISO 14155:2020-07 (section 6.3, Justification de la conception de l’investigation clinique) Investigation clinique des dispositifs médicaux pour les sujets humains – Bonnes pratiques cliniques.
Règlement (UE) 722/2012 : Règlement (UE) concernant des exigences particulières relatives aux exigences fixées dans les directives 90/385/CEE et 93/42/CEE du Conseil concernant les dispositifs médicaux implantables actifs et les dispositifs médicaux fabriqués en utilisant des tissus d’origine animale.
NF EN ISO 7198 : 2017- Implants cardiovasculaires et systèmes extracorporels. Prothèses vasculaires. Greffes vasculaires tubulaires et patchs vasculaires.

Selon le pays où vous menez votre activité PMCF, que vous mettiez en place un registre ou que vous réalisiez une étude observationnelle ou simplement une enquête, l’activité doit être conforme à la norme ISO 14155 et au GDPR.
L’étude PMCF sera menée en conformité avec le GDPR, et selon le pays, elle suit une méthodologie spécifique (des exemples en France et en Allemagne sont fournis ci-dessous).
L’avantage d’utiliser le RWE comme une activité PMCF valide, c’est qu’il nécessite une charge réglementaire légère car l’autorité compétente et l’approbation du comité d’éthique ne sont pas nécessaires tant que la méthodologie de l’activité PMCF ne s’écarte pas de la pratique clinique de routine.

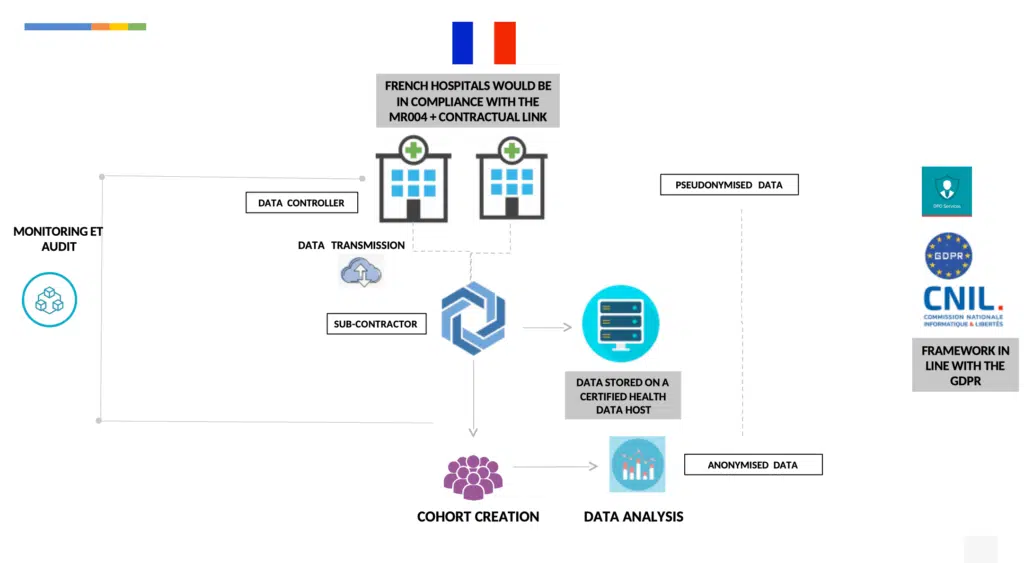
En utilisant une méthodologie de référence appelée ” MR004 ” pour mener des études, des recherches et des évaluations sur des données de santé rétrospectives et prospectives qui n’incluent pas la personne humaine.
Chaque hôpital suivrait la MR004 en tant que responsable du traitement des données, cela comprend :
Réaliser une analyse d’impact sur les données traitées au préalable.
Envoyer des données pseudonymisées (au sens de la section 4 du GRPD)
Délivrer une information au patient : générale, et individuelle (grâce à une page web)
garantir un droit d’accès, de rectification et d’opposition au traitement des données par l’hôpital de chaque délégué à la protection des données
Etablir un contrat avec l’hôpital régissant les obligations relatives au traitement des données personnelles
Ne pas collecter de données relatives aux opinions religieuses, aux infractions ou au NIR.
Autres actions de sécurité entreprises par le sous-traitant :
Collecter les données conformément au principe de privacy by design et privacy by default établi par le GDPR.
Stocker les données collectées sur un hébergement de données de santé certifié (conformément à l’art. R1111-9 du code de la santé publique).

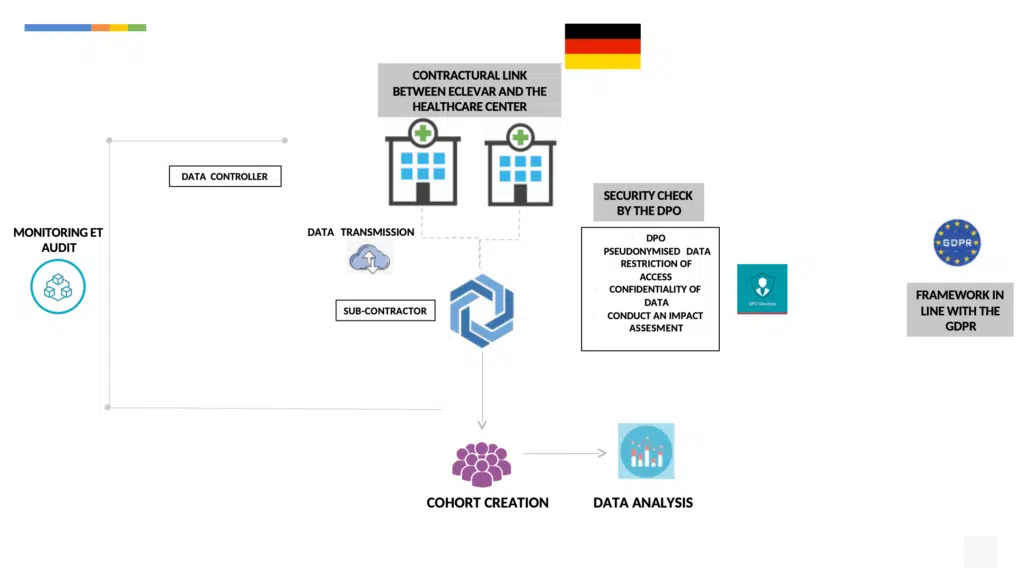
Par dérogation à l’article 9 du GDPR, le traitement des données de santé est autorisé si cela est nécessaire pour des raisons d’intérêt public dans le domaine de la santé publique, pour assurer des normes de qualité élevées dans les dispositifs médicaux (art. 22 du code allemand de protection des données).
Traitement : des mesures appropriées et spécifiques sont prises pour sauvegarder les intérêts de la personne concernée et compte tenu de l’état des connaissances, de l’échelle, de la nature et de la gravité des risques pour les droits et la liberté des personnes physiques.
Mesures visant à assurer la protection des données :
Nomination d’un délégué à la protection des données (DPD)
Réalisation d’une analyse d’impact
Délivrer une information aux patients (art. 13 et 14 GDPR)
Garantir un droit d’accès, de rectification et d’opposition au traitement des données par chaque hôpital du délégué à la protection des données.
Pseudonymisation des données personnelles
Restriction de l’accès aux données personnelles au sein du responsable du traitement.

In the UK, the Information Commissioner’s Office (ICO) is the independent authority set up to uphold information rights in the public interest, promoting openness by public bodies and data privacy for individualsi.
Processing: Research organisations must meet all legal requirements relevant and a legal basis under the UK GDPR must be identified. An Article 9 derogation will likely be required as sensitive personal data is being processed.
Relevant legal frameworks such as the common law duty of confidentialityii through consent must also be met. Though, the interpretation of consent as a legal basis is considered impractical for processing data for health and social care research.
The sponsor, who determines the data to be collected through the protocol, acts as the controller in relation to the research data. If the data is routine data, also collected for other means, such as primary care records then there will be joint controllers of that data. Joint controllers add complexity to the collection and processing of data and must be taken into consideration.
Exemptions pour la recherche
Article 14(5)(b) du GDPR britannique : droit d’être informé lorsque les données sont collectées auprès de sources autres que l’individu.
Annexe 2, paragraphes 27 et 28 du DPA 2018 : droit d’accès.
Annexe 2, paragraphes 27 et 28 du DPA 2018 : droit de rectification.
Article 17(3)(d) du GDPR britannique : Droit à l’effacement
Annexe 2, paragraphes 27 et 28 de la LPD 2018 : Droit de restreindre le traitement
Annexe 2, paragraphe 28 du DPA 2018 : Droit à la portabilité des données – à des fins d’archivage dans l’intérêt public uniquement. Il n’y a pas d’exemption au droit à la portabilité des données pour la recherche scientifique ou historique, ou les statistiques.
Article 21(6) du GDPR britannique et annexe 2, paragraphes 27 et 28 de la DPA 2018 : Droit d’opposition – L’art. 21 est destiné à la recherche scientifique ou historique et aux fins statistiques uniquement. Le paragraphe 28 de l’annexe 2 est destiné à l’archivage dans l’intérêt public.
Un chercheur peut restreindre ces droits, comme le prévoient les exceptions, au motif que le respect de ces obligations empêcherait ou gênerait considérablement le protocole de recherche et les objectifs prévus. Des garanties claires doivent être mises en place pour minimiser le risque de suppression de ces droits. La décision de supprimer ces droits doit être fondée sur des preuves et sur le contexte de ce droit dans le cadre de la recherche à ce moment-là. Par exemple, le retrait d’un participant aux premiers stades d’un projet n’aurait probablement aucun impact, et le droit à l’effacement peut donc être accordé, mais le retrait de 30 % des participants à un stade plus avancé pourrait avoir un impact significatif sur la recherche et ses résultats, et il serait donc plus justifié de recourir à cette exemption.
En raison de l’impact de la sortie de l’UE, le cadre réglementaire britannique nécessite un peu plus d’attention.
Pour l’Irlande du Nord, le MDR de l’UE s’applique, et donc la nouvelle exigence autour du PMCF doit être suivie.
Pour la Grande-Bretagne – Angleterre, Écosse et Pays de Galles, les exigences du PMCF/PMS restent conformes aux directives et aux MEDDEVs pertinents mentionnés précédemment.
Comme pour tous les pays, la protection des données est essentielle lors de l’utilisation du RWD. En mai 2018, le gouvernement britannique a mis en place la loi sur la protection des données 2018 (DPA 2018) ; cette loi a appliqué toutes les clauses du GDPR. À la suite de la sortie du Royaume-Uni de l’UE, le RGPD de l’UE ne protégeait plus les citoyens britanniques. Afin d’éviter la perte de protection des données, le gouvernement britannique a publié une mise à jour de la DPA 2018 appelée “Règlement 2019 sur la protection des données, la confidentialité et les communications électroniques (amendements, etc.) (sortie de l’UE)”. Le GDPR est maintenu dans le droit national en tant que UK GDPR et se situe aux côtés du DPA 2018 modifié.
Les principes clés, les droits et les obligations restent les mêmes. L’introduction du GDPR a pour objectif d’harmoniser les différentes mises en œuvre nationales de la protection des données, bien que le risque d’interprétations divergentes dans la jurisprudence existe désormais.
S'abonner à notre newsletter
30 minutes de conseil gratuit
Pendant 30 minutes, nos experts Eclevar répondront à vos questions et vous guideront dans les étapes suivantes !
VISITEZ-NOUS
ECLEVAR FRANCE:
231 rue Saint-Honoré, 75001 Paris, France.
France
RESTEZ À L'ÉCOUTE