Pour confirmer la sécurité et la performance tout au long de la durée de vie prévue de votre dispositif médical ou DIV, cela comprend :
Les données générées par les activités choisies dans le cadre du PMCF alimenteront votre surveillance post-commercialisation (PMS) et votre rapport d’évaluation clinique (CER)/rapport d’évaluation de la performance (PER).
Votre plan de suivi clinique post-commercialisation doit inclure des activités générales et spécifiques avec un objectif clair pour ces activités. Quelles sont les données que vous cherchez à générer ? Les méthodes sont-elles appropriées ?
Pour répondre à ces questions, vous devez examiner les diverses options d’activité du PMCF.
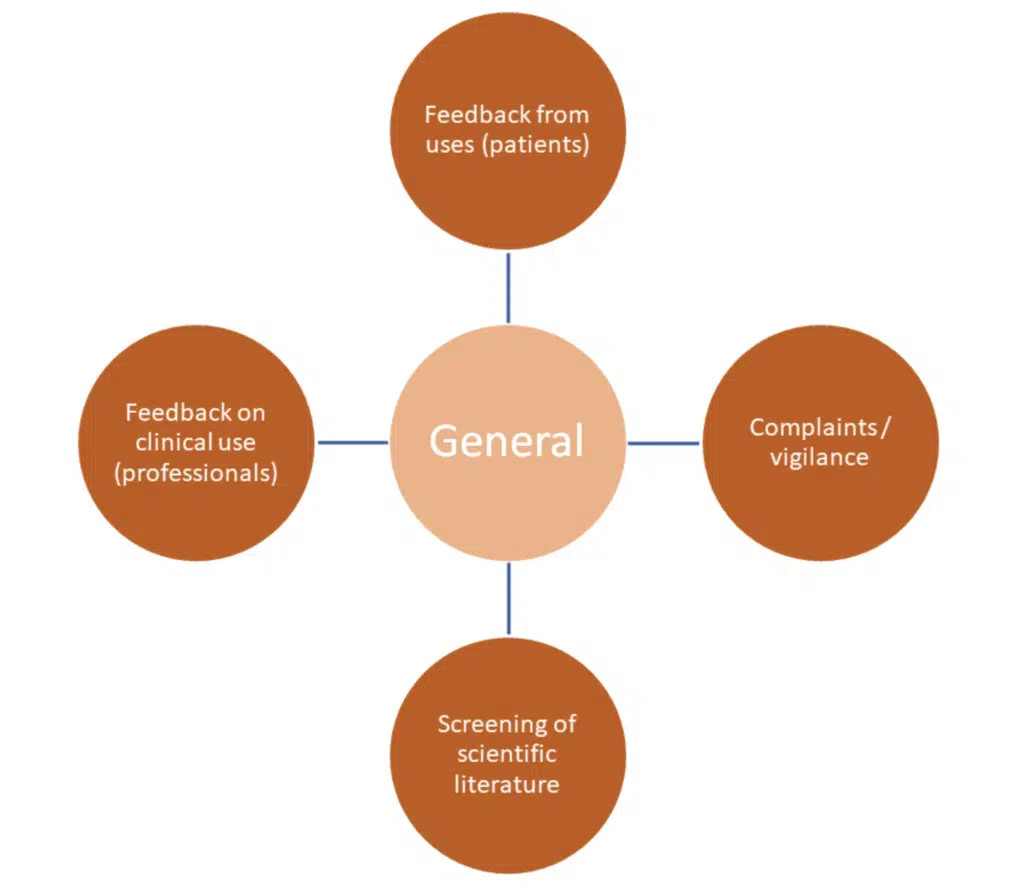
Les activités générales sont de nature à recueillir des informations – souvent des données générales subjectives qui, à elles seules, ne fournissent pas au fabricant des preuves scientifiques solides pour démontrer la sécurité et les performances. Elles doivent être utilisées en conjonction avec des activités spécifiques.
Ces méthodes sont souvent sujettes à des biais et à la variabilité des sources.
Quelques-uns des principaux défis :
Examen de la littérature – données limitées sur le produit examiné, mauvaise qualité de la littérature. Il y a aussi des considérations à avoir sur l’utilisation de dispositifs équivalents et la littérature publiée sur ces dispositifs. Si l’équivalence doit être utilisée, il doit y avoir une démonstration claire de l’équivalence – veuillez consulter le MDCG 2020-5 et contactez-nous en cas de doute.
Accès aux patients et aux utilisateurs : avez-vous mis en place un accès, un consentement et une protection des données adéquats ?
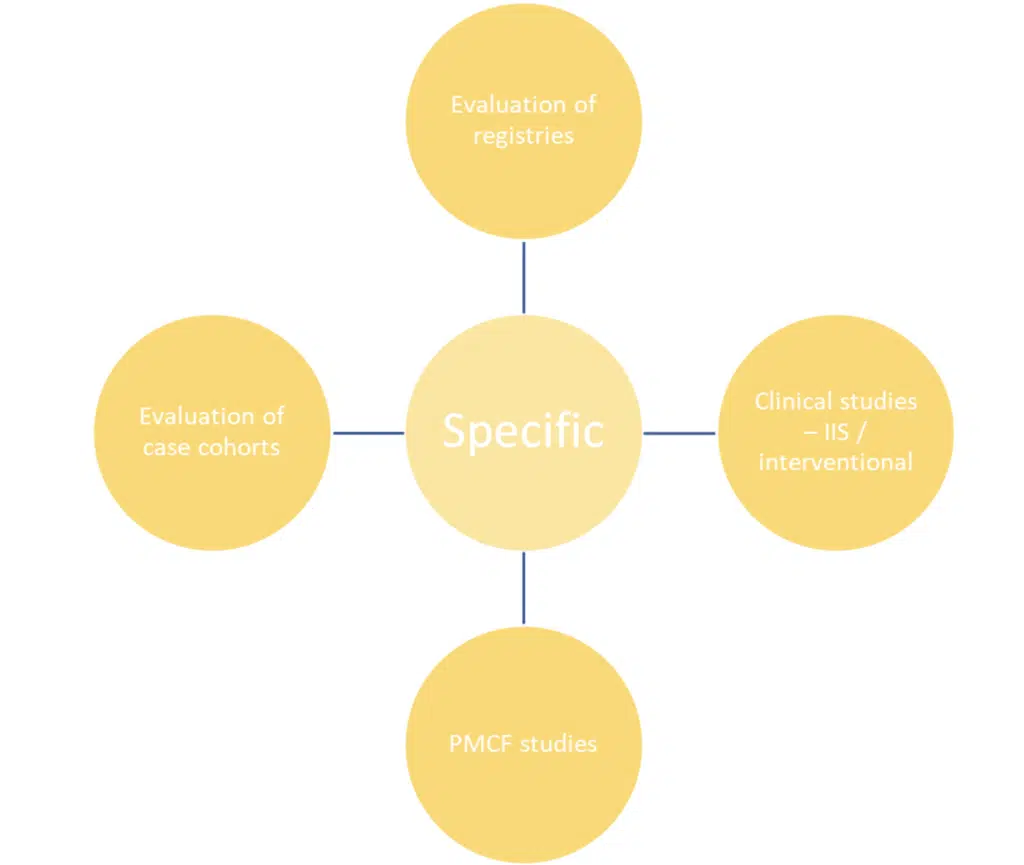
Les méthodes spécifiques sont exactement cela – plus spécifiques et plus adaptées pour générer un ensemble de données scientifiquement significatif. Elles ont un objectif, une population et un ensemble de données mieux définis. Si elles sont bien menées, ces activités vous fourniront les données brutes sur votre produit pour appuyer la démonstration de la sécurité et des performances.
Quelles que soient les activités choisies, le plan du CMFP doit justifier clairement ce choix.
Remarque : elles sont considérées comme obligatoires pour les produits qui :
Ces études doivent avoir des protocoles définis – définissant au minimum : la population et la taille de l’échantillon, les critères d’inclusion et d’exclusion, les objectifs et les critères d’évaluation appropriés et le suivi.
Il peut être nécessaire d’obtenir des autorisations éthiques et des autorisations des autorités compétentes.
Une étude PMCF, comme une étude préclinique, doit être conforme aux attentes de la norme ISO 14155:2020.
Défis :
Registres : Il peut s’agir d’un registre spécifique à un produit ou d’un registre plus vaste pour un type de produit – là encore, il peut s’agir d’une population ou d’une zone plus restreinte ou encore d’un registre national tel que le National Joint Registry.
Un registre bien conçu et bien utilisé peut être une excellente source de données brutes pour votre produit. Une analyse complète a le potentiel de produire des données scientifiques valides sur la sécurité et la performance.
Défis :
Les enquêtes offrent un certain degré de flexibilité, elles peuvent être générales mais aussi conçues pour être très spécifiques – elles peuvent répondre à un large éventail de besoins en matière de production de données.
Les enquêtes générales ont tendance à être rétrospectives – elles demandent à l’utilisateur final de se souvenir d’informations sur l’appareil et son utilisation.
Les enquêtes spécifiques peuvent être menées au niveau du patient et du cas particulier – il peut s’agir d’une enquête unique ou d’une série d’enquêtes qui suivent l’utilisation des dispositifs (prospective). Elles peuvent être réalisées directement auprès du patient ou par l’intermédiaire d’un professionnel de la santé à partir des dossiers des patients. Les données obtenues à partir de ce type d’activité seront de meilleure qualité – produisant généralement des données cliniques sur les dispositifs examinés via les données sur les résultats des patients et les données sur les indications cliniques.
Elles sont également considérées comme relativement faciles à concevoir et à mener.
Cependant, elles doivent être utilisées de manière appropriée et, comme pour toutes les activités, leur utilisation doit être justifiée dans le plan du CMFP.
Défis :
Défis :
Annexe XIV Partie B
6.2. Le plan de la PMCF doit comprendre au moins :
C’est ce qui est exigé au MINIMUM. Les plans PMCF doivent être conçus pour produire des preuves réelles de la sécurité et des performances de votre dispositif dans des conditions normales d’utilisation. Il s’agit d’une collecte de données longitudinale, fournissant des preuves de la sécurité et des performances pendant toute la durée de vie du produit.
Le plan doit être détaillé et justifier clairement les activités choisies – comment vont-elles générer les données que vous cherchez à évaluer. Qu’est-ce qui est pertinent pour votre dispositif ?
Utilisez le modèle de plan PMCF fourni dans le MDCG 2020-7 !
Le MDCG 2020-8 fournit des conseils et un modèle pour le rapport.
Un rapport du PMCF devrait :
s’aligner sur le plan du PMCF
Décrire les activités qui ont été menées
Analyser les données générées par les activités du PMCF
documenter les résultats
faire partie de la documentation technique
doit être mis à jour annuellement Classe III et dispositifs implantables.
Il est essentiel de se rappeler que ce rapport est pris en considération lors de la mise à jour de la CER de votre produit. Il y a un certain nombre de considérations à prendre en compte lors de l’examen des conclusions du cycle du PMCF.
Il s’agit d’un document technique qui doit être présenté de manière claire et dont la conclusion est scientifiquement solide et axée sur la sécurité et les performances du produit. Il s’agit d’un document vivant qui doit être mis à jour et examiné avec soin.
S’il y a des lacunes – cela arrive souvent. Si vous découvrez des “lacunes dans les données” ou un manque de démonstration dans un domaine particulier, il convient de les examiner et de les évaluer. Il faut en faire la démonstration et l’intégrer aux conclusions. S’il s’agit d’une lacune importante, d’autres activités doivent être envisagées et convenues avec votre organisme notifié (le cas échéant). Des lacunes moins importantes peuvent être justifiées, mais des mesures d’atténuation doivent être mises en place pour y remédier à l’avenir. Chaque circonstance est différente, et la décision devra être clairement justifiée et documentée.
Le nouveau règlement prévoit une augmentation significative de l’examen minutieux par l’ON. L’ON est susceptible d’examiner votre plan et vos données de FCGA à certains moments clés :
Il ne s’agit pas d’une liste exhaustive, mais seulement des points clés de l’examen. Encore une fois, il s’agit d’une démonstration de l’approche du “cycle de vie” et de l’examen cohérent tout au long de ce cycle de vie.
Il ne s’agit pas seulement d’une case à cocher, mais d’une fonction essentielle qui renforcera la connaissance de votre dispositif, permettant d’assurer que votre produit continue à fonctionner, que le rapport bénéfice/risque reste acceptable et que les risques sont atténués autant que possible.
Orientation pertinente :
Modèle de plan PMCF MDCG 2020-7 : Un guide pour les fabricants et les organismes notifiés
MDCG 2020-8 Rapport d’évaluation du PMCF : Guide pour les fabricants et les organismes notifiés
MDCG 2021-6 Q&A sur les investigations cliniques
MEDDEV 2.12/2 – Études de suivi clinique post-commercialisation
S'abonner à notre newsletter
30 minutes de conseil gratuit
Pendant 30 minutes, nos experts Eclevar répondront à vos questions et vous guideront dans les étapes suivantes !
VISITEZ-NOUS
ECLEVAR FRANCE:
231 rue Saint-Honoré, 75001 Paris, France.
France
RESTEZ À L'ÉCOUTE